|
|
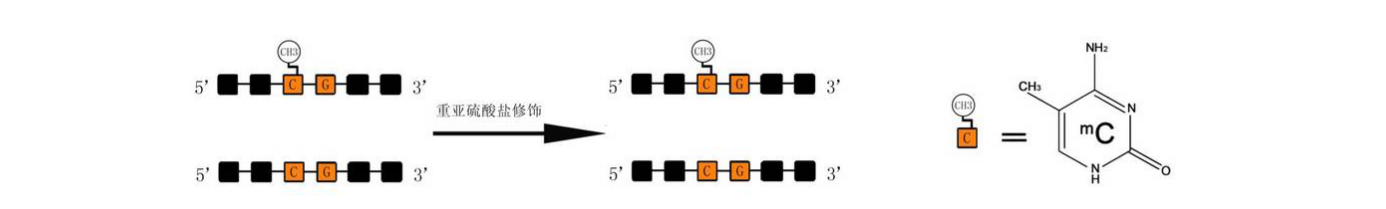
甲基化检测 Methylation detection 实验原理 DNA甲基化存在于大多数真核生物中,一般发生在CpG双核苷酸中胞嘧啶的5’UTR区,起调控作用。CpG的胞嘧啶大概有80%被甲基化,20%处于基因调控区的CpG岛中。BSP甲基化测序(Bisulfite Genomic Sequencing PCR)的原理通过对基因组DNA进行重亚硫酸盐处理,非甲基化的胞嘧啶被脱氨基而转变成尿嘧啶,在随后的PCR反应中尿嘧啶转变成胸腺嘧啶,而甲基化的胞嘧啶不能被脱氨基,在反应完成时被保留(见图5.1),我们将扩增得到的PCR产物进行TA克隆测序,就可以分析甲基化发生的具体情况。该方法实验结果准确性高,是甲基化检测的金标准。
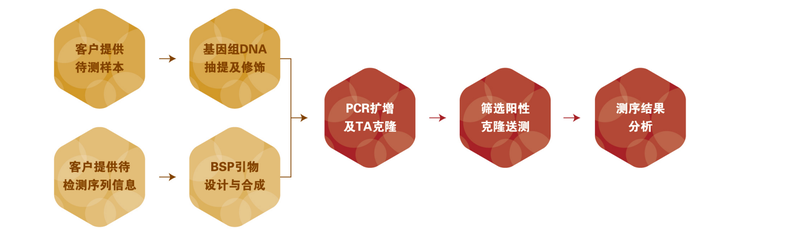
图5.1BSP甲基化检测示意图 技术应用 通过对疾病及正常对照样本的靶基因进行甲基化分析,在研究肿瘤发生机制及早期诊断等方面均具有重要的临床意义。 实验流程
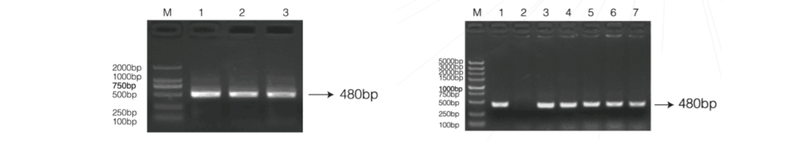
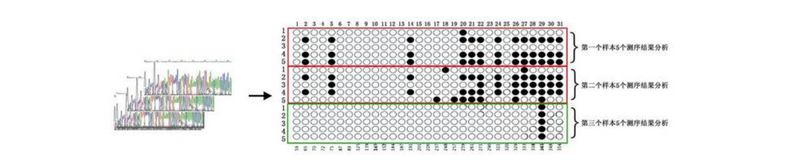
实验结果展示
图5.2待分析的目标片段PCR扩增电泳图 图5.3菌落PCR筛选阳性克隆
图5.4三样本的甲基化结果圈点图分析 注:图中有三个样本,每个样本含5个克隆测序结果,共计15个测序结果。每个圆圈代表一个CG位点,黑圈代表甲基化,白圈代表未甲基化;每一行代表一个样本TA克隆的一个测序结果,序列中所有的CG位点情况可被被罗列,此例序列中共含有31个CG位点。 TROUBLSHOOTLNG
常用问题 FAQ Q:常见的甲基化测定方法有哪些,优缺点是什么?
Q:BSP甲基化检测的关键步骤有哪些? A:1)基因组DNA的重亚硫酸盐修饰:转化效率高低直接影响实验结果,所以需在实验过程中不断摸索合适的实验条件以确保较高的转化效率; 2)BSP引物设计:我们对每个区段设计一到两对引物,引物位置需尽可能的避开DNA中的CG位点,必要时需设计巢式引物,以扩增得到目标片段; 3)PCR扩增:对于较难扩增得到的目标片段,需调整PCR反应条件。 Q:为什么800bp的目标片段要分成2段进行BSP甲基化研究? A:由于基因组DNA被中亚硫酸盐修饰后会发生断裂,平均片段大小在500bp左右,所以每次扩增片段大小不能超过500bp。 Q:客户问:BSP甲基化扩增得到的PCR产物可否直接测序,为什么需要构建TA克隆后测序? A:由于基因组DNA的每个CG位点甲基化程度各不相同,C若未发生甲基化后会修饰成为U,而C若发生甲基化则不变,如果进行PCR产物测序就有可能在原有的C位点得到双峰图,无法确定甲基化的程度,必需通过回收PCR产物,进行TA克隆,随机挑选5-10个单克隆测序的方式才能计算获得每个CG位点的甲基化程度。 Q:如何对BSP甲基化测序结果进行分析? A:我们会采用专业甲基化分析软件对各个TA克隆的测序结果进行分析,分析过程中可以了解到: 1) 测序序列与目的序列的相似度; 2) C-T转化效率; 3) 通过黑白圈点图确认目的片段中每个CG是否发生甲基化; 4) 确认每个CG位点发生甲基化的比例。 Q :怎样确定基因的目标区域来进行甲基化分析呢? A:BSP法甲基化检测首先需要确定甲基化的检测区域,由于甲基化与调控密切相关,因此我们可参考相关文献对已知转录调控区的基因进行甲基化分析。如果转录调控区位置未知,可以通过基因组序列分析确定该基因的转录起始位点、翻译起始密码位置,并分析CpG岛。转录起始位点附近的CpG岛进行DNA甲基化分析的首选区域,一般位于启动子或者5‘UTR区。需要说明的是,预测仅仅是找到可能性大的区域,我们不能保证预测出来得到区域肯定是有甲基化的。 Q:为什么文献报导的甲基化序列不在CpG岛中? A:CG二核苷酸是发生甲基化位点的主要区域,而CG富含区更是甲基化发生几率更高的区域,但是没有明显的CpG岛不代表就没有甲基化,甲基化也可能发生在并不密集的CG区域。 参考文献 1. Li LC. Designing PCR primer for DNA methylation mapping. Methods Mol Biol 2007, 402:371-84. 2.Zhang Y, Rohde C,Tierling S, et al.DNA methylation analysis by bisulfite conversion,cloning, and sequencing of individual clones. Methods Mol Biol. 2009,507:177-87. |